En un artículo previo se presentaron las características fundamentales del desarrollo del magnetismo a partir de la Edad Media. Allí también aparecen algunos de los primeros intentos anticientíficos de utilizar imanes para curar personas y animales, algunos de los cuales persisten hasta hoy.
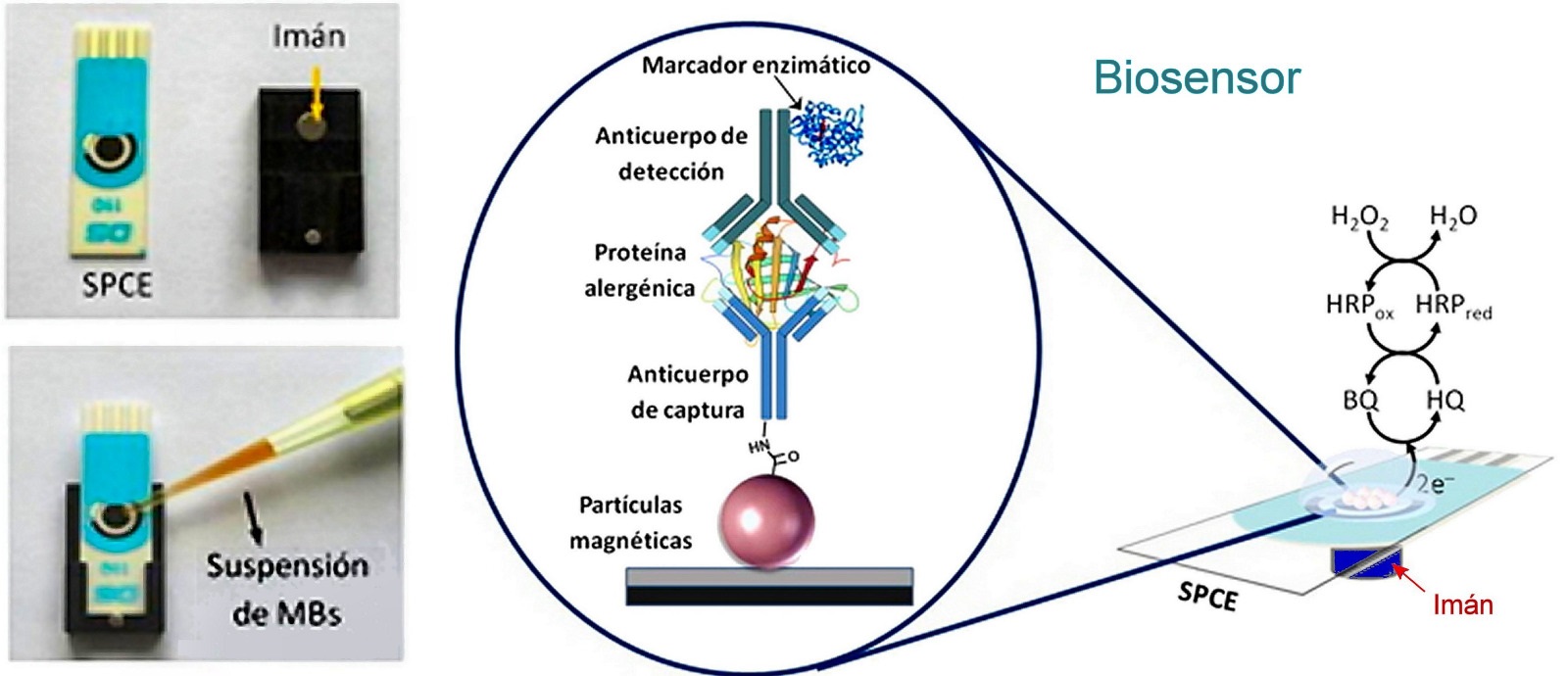
Sin embargo, desde principios de este siglo la anticiencia dio paso a la ciencia de forma paulatina, y los artículos científicos se multiplicaron en las revistas especializadas. La imagen inicial muestra el principio de funcionamiento de un biosensor desarrollado en la Universidad Complutense de Madrid, capaz de detectar alérgenos en los alimentos. Utiliza nanopartículas magnéticas para ‘marcar’ las proteínas específicas, y un imán para aglutinarlas.
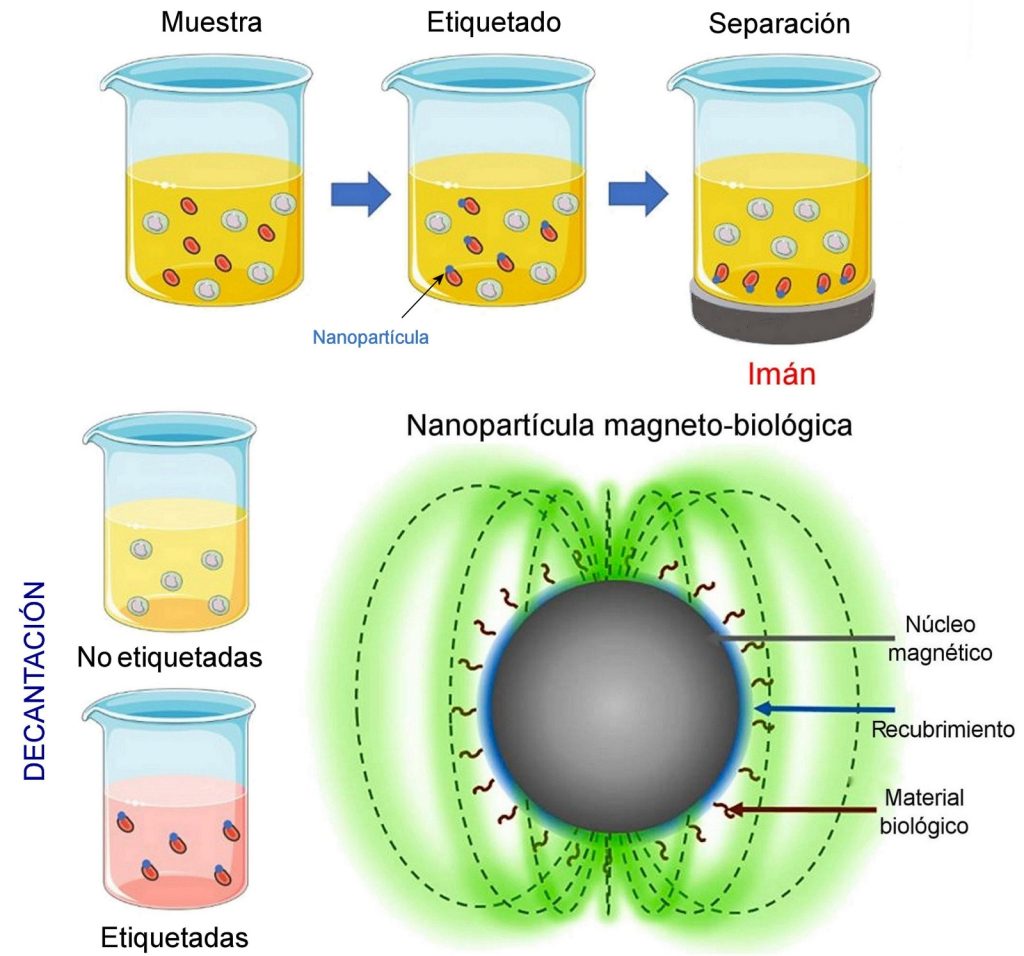
En la actualidad, en lo referente a temas biológicos y médicos, la aplicación más simple del magnetismo es utilizar nanopartículas magnéticas para la separación de células u otras entidades en el laboratorio. Otras aplicaciones empleadas con regularidad son: (1) terapias mediante entrega localizada de medicamentos, (2) métodos de diagnóstico médico, o de detección de sustancias dañinas en alimentos y el medio ambiente y (3) construcción de equipos de imágenes médicas mediante resonancia magnética. Estos últimos serán descritos en otra ocasión.
Separación magnética
Esta técnica utiliza nanopartículas magnéticas para extraer entidades biológicas del medio complejo en que se encuentran; las entidades pueden ser células, enzimas o algunas otras. Tras marcar o etiquetar las entidades seleccionadas, éstas se separan de las restantes mediante algún dispositivo magnético, que puede ser algo tan simple como un imán. Una vez segregadas, es fácil extraerlas de la mezcla líquida que las contiene por decantación o de alguna otra forma (por ejemplo, recolectándolas en un flujo).
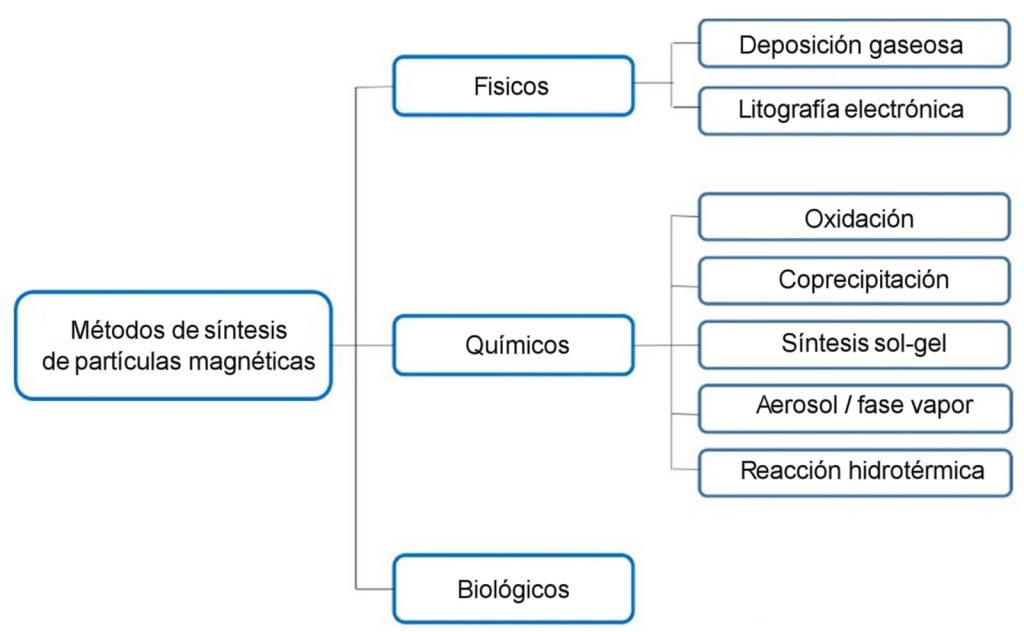
¿Cómo se obtienen las nanopartículas? Existen métodos físicos, químicos y biológicos para obtener las nanopartículas magnéticas; se resumen en el esquema siguiente. Entre los diversos métodos, los de precipitación y coprecipitación son muy utilizados para obtener nanopartículas de metales como Fe, Ni o Co, y de óxidos como la magnetita Fe3O4 o el óxido γ-Fe2O3.
También se usan para obtener aleaciones de Fe-Pd o compuestos más complejos como la ferrita de MnZnGd, actualmente bajo investigación para diversas aplicaciones médicas. Esta metodología también da la posibilidad de obtener partículas recubiertas con una capa de apatita, que imita al hueso. La capa añadida facilita el enlace de ciertas proteínas y medicamentos (ver figura anterior). Información sobre otros métodos se puede encontrar en las referencias.
Suministro de fármacos, genes o radionúclidos
Las principales aplicaciones de las nanopartículas asociadas a terapias y diagnósticos se muestran en la figura siguiente.
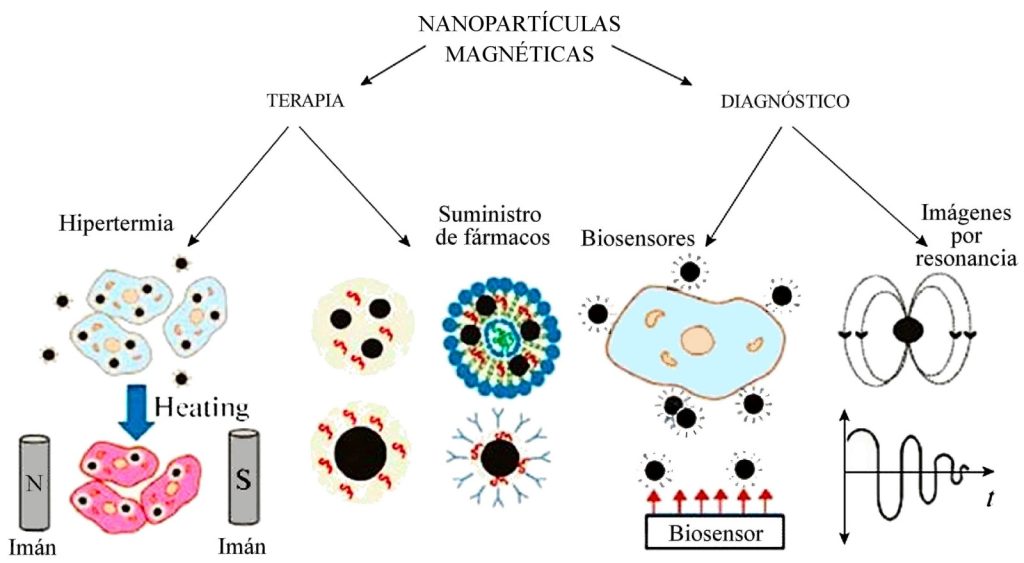
El procedimiento usual consiste en unir el fármaco deseado a las nanopartículas magnéticas. La partícula compleja resultante se mezcla con un líquido portador adecuado para formar un fluido magnético, que puede ser agua o algún solvente orgánico. También se añaden estabilizadores para prevenir la aglomeración de las partículas.
De conjunto con la inyección del fluido magnético en el sistema circulatorio, se colocan uno o más imanes potentes en la región del cuerpo donde se desea concentrar el fármaco, de manera que las nanopartículas tienden a aglomerarse en esas regiones, como se ve en la figura. Una vez concentradas en el lugar deseado, el fármaco se libera mediante cambios en la actividad enzimática, en la acidez (pH) o en la temperatura.
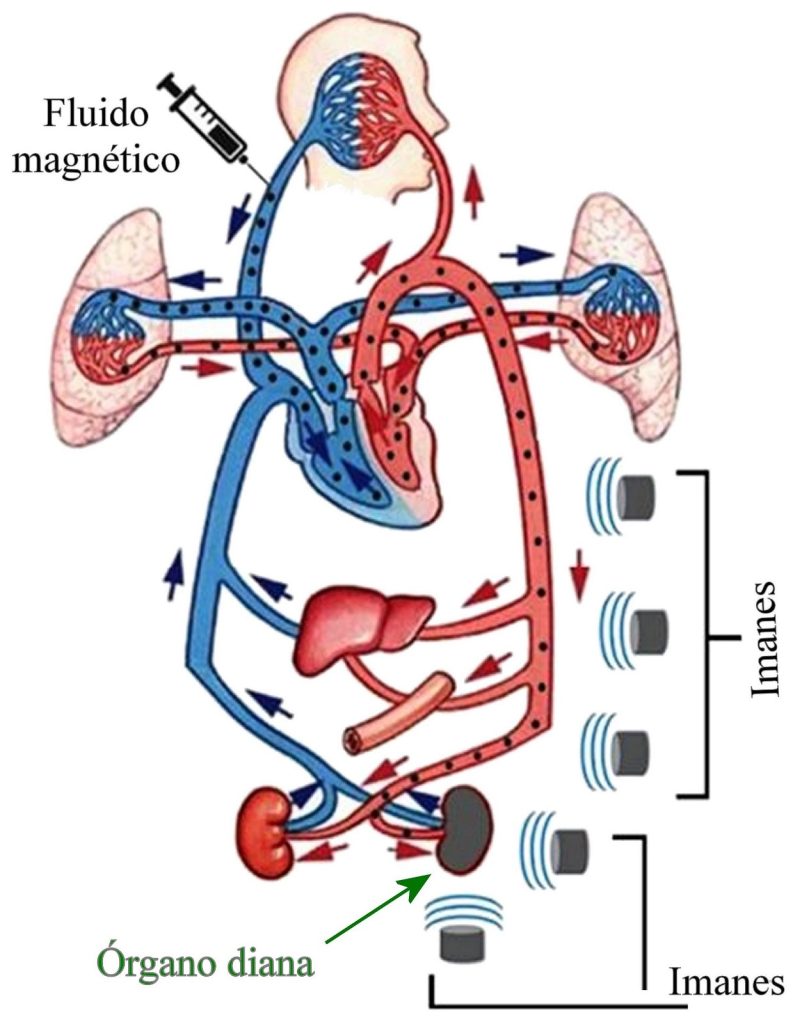
En las quimioterapias aplicadas en el tratamiento de tumores, el mayor inconveniente es que no son específicas para un tipo de células. Al suministrar el producto tóxico para las células malignas por vía intravenosa, el citotóxico se dispersa en todo el cuerpo y ataca tanto al tumor como a las células sanas, con efectos secundarios indeseables (vómitos, caída del pelo, malestar general). Lograr ubicar el fármaco sólo donde se le necesita permite una mejor dosificación y eficacia del tratamiento, junto a una reducción importante de los efectos secundarios indeseables.
Un procedimiento parecido se usa para obtener secuencias de imágenes en los equipos de imágenes por resonancia magnética, los cuales serán analizados en otra oportunidad.
Desintegración de tumores por hipertermia. En ese caso específico se utilizan nanopartículas sensibles al calentamiento por radiación electromagnética. Se concentran en el tumor de la forma descrita antes y luego se calientan aplicando localmente radiación del alta frecuencia (≈ 1.2 MHz); el proceso es similar al que tiene lugar en un horno de microondas. Si la temperatura se logra mantener ½ hora o más por encima del umbral terapéutico de los 42 ºC, el tumor será destruido.
Biosensores
Los métodos de diagnóstico mediante nanopartículas magnéticas con el uso de biosensores han tenido un desarrollo explosivo en las últimas décadas, pues son capaces de proporcionar diagnósticos rápidos, con medios portátiles y de bajo costo. Hoy día los biosensores forman un campo interdisciplinario que combina biología, química, ingeniería y ciencia de materiales, con múltiples aplicaciones en la medicina, alimentos, medio ambiente y diversos dispositivos de seguridad.
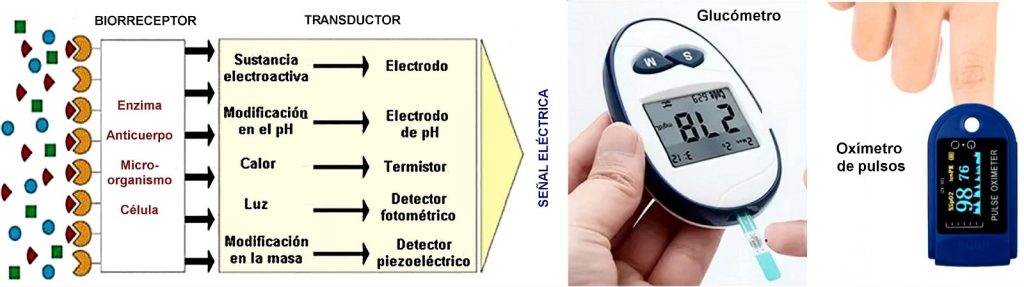
Funcionan sobre la base de principios muy diversos, diseñados para el caso particular que se considere. Un biosensor combina un componente biológico (enzima, anticuerpo, célula, ácido nucleico o microorganismo), el cual se usa como biorreceptor, con un transductor físico-químico (electroquímico, óptico, térmico, piezoeléctrico), que permite detectar de forma cuantitativa un compuesto químico o biológico específico. Ejemplos son: los glucómetros para medir la glucosa en sangre, los tests caseros de embarazo, sensores de COVID-19, o los sensores de toxicidad del agua.
El biosensor al inicio del artículo se usa detectar proteínas alergénicas del maní en la saliva, y en los alimentos que pudieran contenerlas. El biorreceptor es enzimático, con un transductor electroquímico que funciona sobre la base de agua oxigenada e hidroquinona. Las micropartículas magnéticas se usan como soportes del biorreceptor para ser atraídas mediante un imán hacia los electrodos de carbono que determinan la concentración por vía electroquímica.
Este biosensor es capaz de detectar trazas de los alergénicos del maní de hasta 1 ppm (parte por millón) en extractos de alimentos y en la saliva humana.
Bibliografía
Magnetic particles for integrated nucleic acid purification, amplification and detection without pipetting. Trends in Analytical Chemistry 127 (2020) 115912, https://doi.org/10.1016/j.trac.2020.115912
Hongzhi Hu et. al., Promising application of Pulsed Electromagnetic Fields (PEMFs) in musculoskeletal disorders, Biomedicine & Pharmacotherapy 131, 110767, https://www.sciencedirect.com/science/article/pii/S0753332220309604
Biosensores Electroquímicos para la Determinación Individual o Simultánea de las Proteínas Alergénicas del Cacahuete (Ara H1 Y Ara H2) En Extractos Alimentarios y Saliva, Universidad Complutense,https://www.ucm.es/otri/complutransfer-biosensores-electroquimicos-para-la-determinacion-individual-o-simultanea-de-las-proteinas-alergenicas-del-cacahuete-ara-h-1-y-ara-h-2-en-extractos-alimentarios-y-saliva
Yu. A. Koksharov, et al. Magnetic Nanoparticles in Medicine: Progress, Problems, and Advances. Journal of Communications Technology and Electronics, 2022, Vol. 67, No. 2, pp. 101— 116. © Pleiades Publishing, Inc., 2022. Russian Text © The Author(s), 2022, published in Radiotekhnika i Eiektronika.