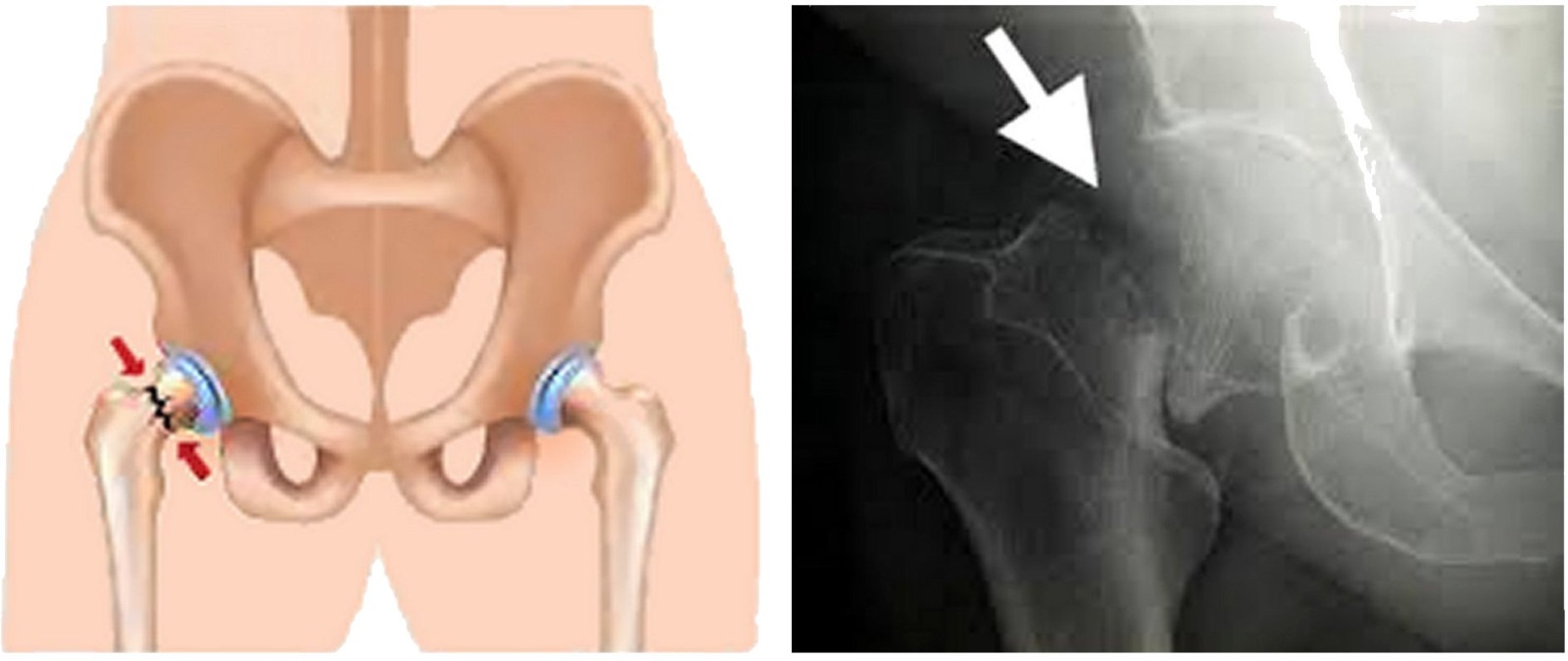
En la imagen se aprecia un ejemplo de fractura de cadera común.
Los fraudes cometidos por Yoshihiro Sato son de los que más efectos han tenido en la comunidad científica. Sus artículos han sido citados y utilizados por muchos, dando origen a ensayos clínicos innecesarios, a metaanálisis que proporcionaron conclusiones falsas, y a directrices erróneas de sociedades médicas.
No hay mucha información accesible acerca de los estudios de Sato o de su vida personal; tampoco fotos suyas en la WEB (y sí de otros con el mismo nombre). De todos los investigados en esta serie de artículos, ha sido el que más dificultades presentó para reunir datos confiables. Se sabe que ejerció como osteólogo durante 13 años en el Hospital Mitate de Tagawa, una pequeña ciudad en la isla de Kyushu, en Japón y que fue profesor de la Escuela Médica Universitaria de Hirosaki en los años 2000-2003, pero no mucho más.
Por otra parte, sí aparece bastante información sobre cómo fue que diversos investigadores notaron que había algo que no cuadraba en las publicaciones de Yoshihiro Sato, los pasos que tomaron al respecto y la forma en que reaccionaron las diversas revistas que habían publicado sus artículos. Se necesitó un proceso que duró más de diez años para que se tomaran en cuenta las denuncias acerca de sus artículos y salieran a la luz sus engaños.

Por el hilo se saca el ovillo
Loa engaños de Sato no fueron descubiertos “de un tirón”, sino más bien “poquito a poco”. Así, en un artículo de la revista Neurology de 2005, Sato reportó que el fármaco risedronato reduce el riesgo de fracturas de cadera en un 86% en mujeres que han sufrido previamente un derrame cerebral. Pero tres investigadores de la Universidad de Cambridge en el Reino Unido, en una carta enviada a la revista, señalaron que el estudio era “potencialmente de gran importancia”, aunque mostraron dudas ante el hecho de que los autores hubieran logrado reclutar a 374 pacientes con esas características específicas en solo 4 meses, así como sobre las escasas deserciones que ocurrieron en el transcurso de la investigación.
En 2007 surgió otra carta en relación a una nueva publicación de Sato sobre el mismo fármaco en la revista Archives of Internal Medicine. El estudio se refería a pacientes masculinos que habían sufrido un accidente cerebrovascular. La carta, enviada por varios miembros de un boletín alemán que publica temas sobre la industria farmacéutica, expresaba gran preocupación acerca de la validez de los datos publicados. Según la publicación, Yoshihiro Sato había logrado reclutar a 280 pacientes en tan sólo dos meses. Otro estudio, sobre mujeres con enfermedad de Alzheimer, había reclutado nada menos que 500 en un período igualmente breve, con muy pocas deserciones. Sato también afirmaba haber diagnosticado él mismo a todos los pacientes de Alzheimer y haber realizado evaluaciones de seguimiento de los 780 sujetos cada cuatro semanas, durante 18 meses. En ambos artículos se demostraba, nuevamente, que el RISEDRONATO era un éxito rotundo.
Cuando la revista lo contactó sobre las dudas, Sato envió una respuesta donde pedía disculpas; declaró que el estudio se había realizado en tres hospitales, no en uno, pero no lo habían divulgado porque “estos hospitales se mostraron reacios a que sus nombres aparecieran en el artículo”. No nombró los hospitales, y tampoco dio las razones por las qué querían permanecer anónimos. La revista aceptó la explicación.

Pero los autores de la carta a los Archives también habían detectado un patrón preocupante. Al revisar otras revistas, encontraron 11 estudios adicionales de Sato que demostraban que la luz solar, la vitamina D, la vitamina K, el folato y otros medicamentos podían reducir el riesgo de fracturas de cadera. En 9 de ellos se informaban “efectos extremadamente grandes con resultados significativos”. Sin embargo, a los editores de Archives of Internal Medicine no les pareció apropiado mencionar críticas a artículos publicados en revistas ajenas. En su respuesta a los autores de la crítica, escribieron: “Puede aludir a su preocupación de que otros artículos hacen surgir inquietudes similares” pero no les permitieron mencionar el nombre de otras revistas en la suya.
Y después no sucedió nada más; el asunto se enfrió durante unos 5 años.
Un antecedente de lo que ocurriría después tuvo lugar en 2006, cuando la especialista en nutrición de la Universidad de Aberdeen en Reino Unido, Alison Avenell, encontró una coincidencia inexplicable mientras realizaba una revisión bibliográfica para evaluar si la vitamina D reducía el riesgo de fracturas óseas. Dos artículos de Sato que describían diferentes ensayos clínicos con pacientes no relacionados ‒ uno en víctimas de derrame cerebral, el otro en aquejados con la enfermedad de Parkinson ‒ presentaban igual índice de masa corporal promedio en los grupos de control y de estudio. ‒ Algo prácticamente imposible desde el punto de vista estadístico ‒. Al investigar más a fondo encontró otras anomalías en los estudios, razón por la cual decidió no incluirlos en sus análisis, pero no realizó alguna otra acción.
Y pasó el tiempo y pasó… lo que tenía que pasar
Pero sucedió que en 2008 Alison comenzó a colaborar con el grupo de investigación de Mark Bolland, epidemiólogo de la Universidad de Auckland, Nueva Zelandia, para realizar un metaanálisis sobre suplementos de calcio. Un asunto que interesaba al grupo de Bolland, y era objeto de discusiones regulares, era el por qué los metaanálisis sobre un mismo tema a veces llegan a conclusiones diferentes.
Un metaanálisis es un análisis estadístico de los resultados reportados por diferentes investigadores sobre un tema particular. Lo usual es seguir un criterio de selección que permita incluir solo aquellos resultados más confiables (por ejemplo, aquellos que comprendan un gran número de pacientes y no presenten sesgos o errores de entrada, tal como una selección deficiente al escoger los grupos de ensayo y de control). Los metaanálisis proporcionan una mayor precisión y confiabilidad que los estudios independientes, y sus resultados se pueden generalizar a una población de mayor amplitud. Hoy día es una herramienta muy utilizada en medicina.
Durante la interacción de Avenell con el grupo de Bolland, en 2012 salieron a relucir los estudios de Yoshihiro Sato; sus resultados eran tan fuertes que cambiarían las conclusiones de los metaanálisis si fueran incluidos en las estadísticas.

A Bolland le impactó el gran número de pacientes, la alta retención y los extraordinarios efectos de casi todos los tratamientos probados. La productividad del pequeño grupo de investigación de Sato (33 ensayos en 15 años), así como el reclutamiento y alta retención de pacientes de la tercera edad que compartían comorbilidades (otras enfermedades), eran asombrosas para alguien acostumbrado a analizar este tipo de investigaciones. Además, los excelentes resultados reportados en la reducción de fracturas de cadera ‒ con el uso de diversos fármacos ‒ no eran consistentes con los obtenidos por otros grupos al estudiar los mismos fármacos.
Otros datos controvertidos eran los siguientes. En un artículo sobre 780 pacientes con Alzheimer, estudiados durante 18 meses, los datos individuales se recopilaban cada 4 semanas. Seguir diariamente a 25 pacientes desde un hospital de una pequeña ciudad japonesa raya en lo imposible (todo el mundo asumía que habría colegas anónimos que lo ayudaban; no había otra explicación). Otro estudio de 2003 durante 3 años trataba sobre 40 pacientes japoneses con una enfermedad muy rara; como en el resto del mundo es muy difícil que un osteólogo se encuentre con más de dos casos durante toda su vida, muchos pensaron que esa rara enfermedad debía ser muy prevalente en la pequeña ciudad de Japón donde trabajaba Sato ‒ lo que no era así, como después se comprobó.
La ciencia real en acción
Para verificar los resultados de Sato, Bolland recurrió a las estadísticas. Analizó las características de los 33 ensayos clínicos que Sato había publicado hasta el momento ‒ más de 500 variables en total ‒ y encontró que los grupos de ensayo, que se debían haber escogidos aleatoriamente (al azar) eran demasiado similares, hasta el punto de que la única explicación plausible era que Sato había inventado datos para ambos grupos, y los había hecho más parecidos de lo que nunca habrían podido ser en la vida real.
Más que hacer una denuncia a un grupo de revistas, el team Avenell/Bolland llegó a la conclusión de que lo mejor era publicar un artículo para que investigadores independientes, revistas e instituciones, indagaran sobre cada caso particular. Así lo hicieron en marzo de 2013. El artículo, titulado Systematic review and statistical analysis of the integrity of 33 randomized controlled trials (Revisión sistemática y análisis estadístico de la integridad de 33 ensayos controlados aleatorizados) fue enviado al Journal of the American Medical Association (JAMA), una de las revistas en que Sato había publicado.
El editor jefe de la revista respondió que pediría una respuesta a Sato y a su institución….y el asunto se enfrió por dos años más. Al cabo de ese tiempo la revista informó a Bolland que el hospital no había respondido, que no publicaría el artículo de denuncia, y que sólo publicaría una “expresión de preocupación” sobre el artículo particular publicado en JAMA, sin mencionar los 32 ensayos restantes.
Ante la negativa, Bolland y su grupo enviaron el artículo a otras revistas donde Sato había publicado, pero también les negaron su publicación; en todo caso, a lo más que se comprometieron fue a investigar los artículos de Sato. Ya al borde de reconocer su derrota, en junio de 2015 ‒ 10 años después que aparecieran las primeras dudas sobre Sato ‒ el grupo de Bolland tuvo un pequeño éxito: el Journal of Bone and Mineral Research retractó uno de los 33 ensayos que ellos habían analizado; en los meses siguientes otras revistas siguieron el mismo ejemplo.
En diciembre de 2015, cuando ya habían tenido lugar unas cuantas retractaciones, el grupo de Bolland presentó el artículo a la revista Neurology, y fue finalmente aceptado ocho meses después. En esa revista Sato había publicado tres artículos sobre fracturas óseas en pacientes con enfermedades neurológicas. En diciembre de 2016, cuando Neurology publicó la investigación, 10 de los 33 ensayos de Sato ya habían sido retractados, nueve de ellos por revistas con las que el equipo se había puesto en contacto. Para 2017 las retractaciones ascendían a 17.
En enero de 2017 el grupo recibió la noticia de que Sato había muerto. Inicialmente su muerte estuvo envuelta en el misterio, hasta que finalmente se confirmó su suicidio en 2018. Tres meses antes de su muerte, cuando aún estaba abierta la investigación, Sato se responsabilizó por los fraudes, solicitó la retractación de algunos de sus artículos y eximió de culpa los colaboradores al declarar que firmaron los artículos sin haber contribuido a ellos.
Tiró la piedra… y escondió la mano
El fraude también atrajo la atención sobre dos coautores; sus nombres son los que aparecen con más frecuencia en los artículos de Sato. Uno de ellos, Kei Satoh, quien fuera presidente de la Universidad de Hirosaki en Honshu, una pequeña ciudad en el extremo norte de la principal isla de Japón, al parecer no tuvo mayores problemas. Sostuvo que su función fue solo corregir el inglés de los artículos. Yoshihiro Sato había trabajado en la Universidad de Hirosaki hasta 2003, pero Kei continuó siendo un coautor frecuente tras marcharse Sato de la universidad. Su nombre aparece en 13 de los 33 ensayos clínicos.
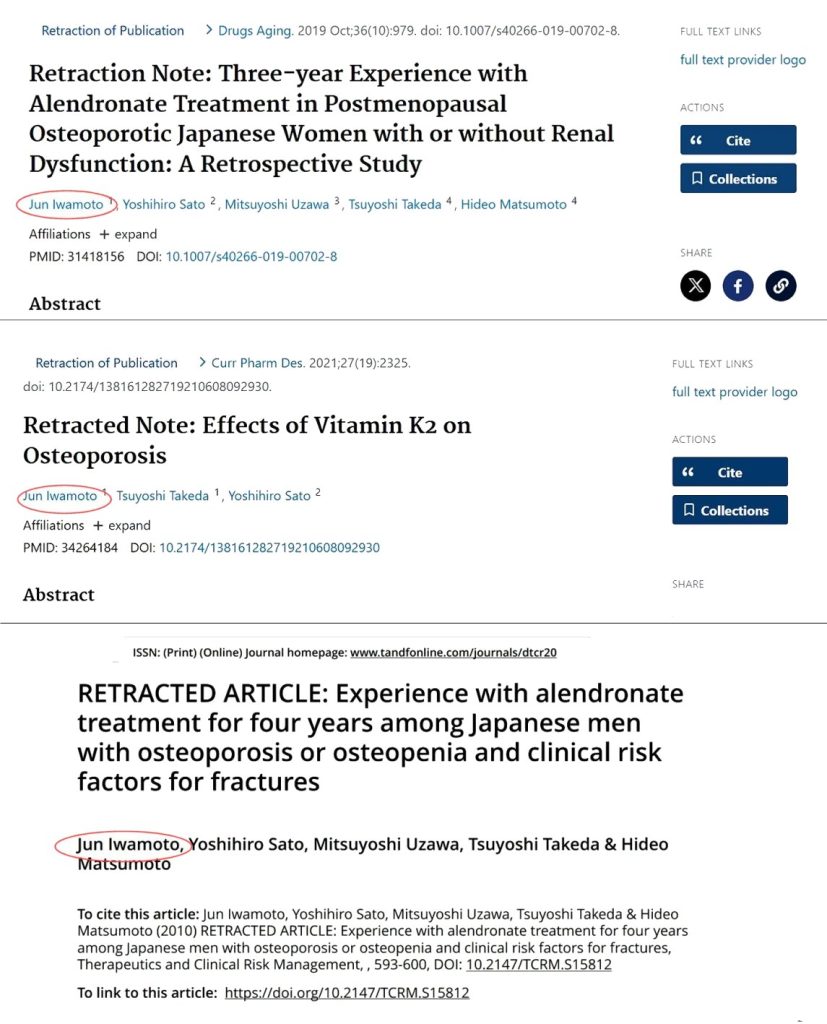
El otro coautor habitual, Jun Iwamoto, quien fuera miembro de la junta directiva de la Sociedad de Osteoporosis de Japón y profesor titular en la Universidad Keio de Tokio hasta 2017, no tuvo la misma suerte; su contrato no fue renovado a raíz de las investigaciones sobre Sato. Ambos colaboraron durante más de una década y publicaron unos 130 artículos conjuntos, incluidos 25 de un total de 33 ensayos clínicos. Más tarde, en una entrevista a la revisa Science, el abogado de Yoshihiro Sato informó de una nota que este había dejado: “Lo siento mucho por el señor Iwamoto. Decidí suicidarme”.
Al ser cuestionado sobre su participación, Iwamoto alegó que desde 2002 comenzaron a poner el nombre del otro en cada artículo que escribían, y que no sabía nada de la mala conducta de Sato, pero una comisión de la Universidad también encontró problemas en los ensayos clínicos donde Iwamoto era primer autor. A pesar de que Sato trató de librar a Iwamoto de sospechas, y de las alegaciones de este último de que lo incluía en los artículos sin su conocimiento, se han retractado 74 publicaciones donde Iwamoto aparece como primer autor. Una lista de 15 de sus artículos retractados hasta 2022 aparece en la referencia al final (Other papers submitted by…).

Al parecer, cuando todo se descubrió, Jun Iwamoto “paso a la clandestinidad”. Como expresa el conocido dicho sobre María Ramos, “tiró la piedra y escondió la mano”. No aparecen sus datos ni fotos en la WEB, nunca contestó los mensajes de las revistas y tampoco lo hizo su antigua institución.
Repercusiones negativas
El daño ocasionado por Sato a las investigaciones sobre las fracturas de cadera es muy grande. Un metaanálisis realizado por un grupo de investigadores, que concluyó que los BIFOSFONATOS son altamente efectivos para prevenir fracturas de cadera en pacientes mayores con accidente cerebrovascular o enfermedad de Parkinson, se basa totalmente en ocho ensayos de Sato, ya que él fue el único que estudió el tema. Una conclusión clave en otro metaanálisis se basa únicamente en los cuatro estudios de Sato sobre la densidad mineral ósea en pacientes con Alzheimer.
Otros dos metaanálisis probablemente llegarían a conclusiones diferentes si se eliminaran los ensayos de Sato. Uno de ellos, referido a una revisión que muestra que la vitamina K ayuda a prevenir fracturas, fue la base de las pautas japonesas de 2011 que recomiendan el suplemento para personas en riesgo.
Avenell siguió revisando la literatura para analizar el impacto de los falsos estudios de Sato; se han citado más de mil veces y 23 revisiones sistemáticas o metaanálisis han incluido uno o más de sus ensayos más importantes. Ocho ensayos posteriores de otros autores citaron al menos uno de los artículos inventados de Sato para explicar la justificación del ensayo, con la consiguiente pérdida de tiempo, esfuerzos, recursos y molestias innecesarias a pacientes.
Por ejemplo, en 2008 investigadores de los Países Bajos iniciaron un estudio de gran envergadura para determinar si las vitaminas B podían ayudar a prevenir las fracturas de cadera. Dos estudios anteriores habían concluido que no era así, pero Sato había reportado “un gran efecto protector” en mujeres mayores. El estudio de dos años, en 2919 personas de la tercera edad, no encontró ningún efecto de las vitaminas.
Es posible que aún queden artículos de ambos autores, Sato e Iwamoto, pendientes de decisión en algunas revistas.
Bibliografía
- Systematic review and statistical analysis of the integrity of 33 randomized controlled trials, http://www.neurology.org/content/early/2016/11/09/WNL.0000000000003387
- University investigation finds misconduct by bone researcher with 23 retractions, file:///2017/12/06/university-investigation-finds-misconduct-bone-researcher-23-retractions/?relatedposts_hit=1&relatedposts_origin=51732&relatedposts_position=0&relatedposts_hit=1&relatedposts_origin=51732&relatedposts_position=0
- Tide of lies, Science 361: 636-641 (17 Aug 2018), https://doi.org/10.1126/science.361.6403.636
- Researcher at the center of an epic fraud remains an enigma to those who exposed him | Science | AAAS, https://www.science.org/content/article/researcher-center-epic-fraud-remains-enigma-those-who-exposed-him
- Whistleblowers flagged 300 scientific papers for retraction. Many journals ghosted them,https://www.science.org/content/article/whistleblowers-flagged-300-scientific-papers-for-retraction-many-journals-ghosted-them
Instances of Scientific Misconduct | Jun Iwamoto | Best Practices in Science, https://bps.stanford.edu/home/instances-scientific-misconduct/instances-scientific-misconduct-jun-iwamoto
Instances of Scientific Misconduct | Yoshihiro Sato | Best Practices in Science, https://bps.stanford.edu/home/instances-scientific-misconduct/instances-scientific-misconduct-yoshihiro-sato
Poster (en japonés), https://www.hirosaki-u.ac.jp/30242/
Other papers submitted by: Dr Jun Iwamoto, https://www.dovepress.com/author_profile.php?id=1853
Kei Satoh’s research while affiliated with Hirosaki University and other places https://www.hirosaki-u.ac.jp/wordpress_data/annai/kanko/gaiyo/summary25_e.pdf