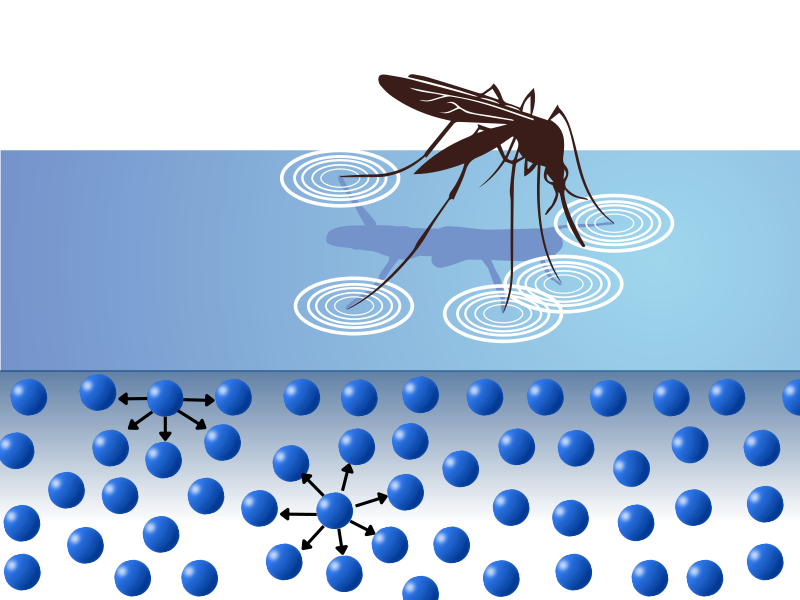
Imagina una situación relativamente cotidiana. Algo como presionar un gotero sobre un vaso o pasar agua de un vaso a otro. Al hacerlo, se precipitan gotas iguales y uniformes hacia el vaso, que se descomponen al chocar con el fondo y van llenando el recipiente. Si prestamos atención al detalle, podemos ver que las gotas son iguales, exactamente iguales.
Analicemos el caso siguiente. Al voltear el vaso tan lentamente, el agua no se precipita en una línea recta hacia el otro, sino que caprichosamente se desliza por las paredes exteriores del vaso y parte de nuestra preciada agua acaba derramada. El agua parece oponerse a la gravedad, fluyendo un poco antes de caer. ¿Es esto posible?
Tal propiedad, denominada tensión superficial, puede ser explicada de manera simple, aunque tiene como consecuencia muchos otros efectos extraños y se da, no solo en el agua, sino en todos los líquidos.
La tensión superficial es una propiedad físico-química según la cual los líquidos forman en su superficie una especie de membrana elástica capaz de soportar objetos de mayor densidad que dicho líquido. Existe, entonces, una fuerza neta hacia arriba, debida a dicha tensión que, sumada a la fuerza de empuje, equilibra al peso del objeto. Tal fuerza de tensión superficial es ejercida a lo largo de toda la superficie de contacto entre el objeto y el líquido.
Existe cierto coeficiente de tensión superficial para cada líquido dependiente de la temperatura y el medio circundante. De esta forma, la superficie del líquido actúa como una membrana elástica que, si es capaz de soportar al cuerpo, este descansa sobre la superficie, cual acróbata en una cuerda. Esta propiedad es la que permite a insectos como el Zapatero Rhagovelia pararse sobre el agua, ya que el peso distribuido de sus patas es resistido por la “membrana” en la superficie, permitiéndole posarse en ella. Por esto mismo, hojas y flores también pueden flotar, a pesar de ser más densas que el agua.
En una aguja, por ejemplo, la fuerza de tensión superficial actúa a lo largo de su longitud, a ambos lados de la interfaz entre esta y el agua, siendo doble la longitud de contacto. Si la tensión superficial es rota (se rompe la membrana) el objeto se hunde, al ser más denso que el agua.
¿Por qué tiene lugar la tensión superficial?
Las fuerzas entre las moléculas del medio (el área o espacio) de un líquido se diferencian bastante de las fuerzas entre las moléculas de su capa superficial. Por su carácter dipolar (el agua se enlaza como si de los polos de un imán se tratara: negativo, carga parcial de oxígeno; con positivo, la carga parcial de hidrógeno), las moléculas de agua se atraen entre sí y forman enlaces por puentes de hidrógeno (el oxígeno de una molécula atrae a sus dos hidrógenos y a los de otra molécula; esta atrae a los suyos y a los de otra molécula, la cual atrae los suyos y los de otra; así sucesivamente). Las moléculas de agua se mantienen fuertemente unidas gracias a estas fuerzas de cohesión intermoleculares.
Si algo nos ha quedado claro, es que las moléculas de agua están fuertemente “pegadas”. En el interior del líquido, las moléculas son cohesionadas por otras que les rodean (moléculas de agua que están a su alrededor). Sin embargo, las de la capa superficial solo son cohesionadas por esas mismas moléculas de la superficie y aquellas debajo de estas, ya que encima no hay moléculas de líquido y la interacción líquido-aire es más débil. Por lo tanto, las moléculas de la capa superficial están más unidas entre sí (tienen menos moléculas que las atraigan alrededor, por lo que se unen más entre ellas), dando una fuerza neta hacia el interior del líquido.
En cambio, en las moléculas del interior del líquido las fuerzas de cohesión hacia abajo se equilibran con otras que apuntan hacia arriba, ya que hay moléculas alrededor. La fuerza neta hacia abajo en la superficie hace que esta se encoja tanto como sea posible y se tense (ahí tenemos la “tensión” de nuestra “tensión superficial”). Si deseamos mover una molécula interior a la superficie, hay que vencer la fuerza mediante un trabajo externo. Una molécula en la superficie tiene una energía mayor que una en el seno del líquido.
Habíamos visto que las moléculas en la superficie tenían más energía que aquellas en el interior. Sencillo, ¿cierto? Pues esto plantea un problema, ya que los sistemas mecánicos tienden a adoptar espontáneamente el estado de menor energía potencial.
Los líquidos tienden a presentar el estado de menor superficie posible (a más superficie, más energía, recuerda). ¿Cómo hacen esto? Simplemente, mediante la formación de gotas. Sí, gotas esféricas. Si una molécula de líquido se encuentra más cerca de la superficie, la fuerza resultante hacia abajo, por la asimetría de la distribución de moléculas del líquido (hay más arriba y menos abajo) será mayor (más cerca de la superficie, mayor fuerza resultante hacia abajo).
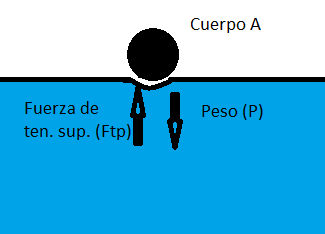
En la superficie, esta fuerza es la mayor posible en el líquido. Al apoyar un cuerpo sobre la superficie del agua, tensada como una membrana elástica, el cuerpo ejerce una fuerza sobre esta membrana y esta una reacción sobre el cuerpo (cuerpo A ejerce fuerza sobre B, cuerpo B ejerce fuerza sobre A de igual valor y dirección, pero sentido contrario; tercera ley de Newton, recuérdalo). Esta es la fuerza que hace a la membrana tendiente a recuperar su posición de equilibrio (la membrana empuja al cuerpo porque quiere seguir recta y no estirada). Así el cuerpo experimenta la fuerza de tensión superficial.
La tensión superficial depende del líquido; de las fuerzas de atracción-cohesión de sus propias moléculas. También de la temperatura. En general, disminuye con el aumento de la temperatura, debido a la disminución de las fuerzas cohesión con el aumento de la agitación térmica (recuerda, cuando las cosas se calientan sus partículas se mueven y se mueven más cuanto más calor hay). Además, depende del medio en contacto con la superficie del líquido o medio exterior, ya que las moléculas de este ejercen acciones atractivas sobre las moléculas en la superficie, que contrarresta las acciones de las moléculas del líquido.
Conceptos
Cohesión: Es una fuerza de atracción entre las moléculas del mismo tipo. Ejemplo: Se cohesionan moléculas de agua, de aire, de mercurio, etc.
Adhesión: Es una fuerza de atracción de moléculas de un tipo por moléculas de otro tipo. Ejemplo: Atracción entre las moléculas de un líquido y el recipiente que las contiene.
Cuando vertemos agua en un vaso, entre sus moléculas existe una fuerza de cohesión que supera un poco a la fuerza de adhesión entre el agua y el vaso en el que se encuentra. Si continuamos llenando el vaso, la línea que forma la superficie del agua permanece relativamente recta. Sin embargo, si lo llenamos de tal manera que amenace con desbordarse, veremos cómo se forma una comba (una ligera protuberancia de agua) antes de desbordarse, mientras resiste unas gotas más de agua. ¿Por qué? Pues, porque esas moléculas de agua atraen fuertemente a las nuevas y esa cohesión impide que se desborde. Como extra, es esta fuerza de cohesión la que permite la existencia de… ¡gotas! Estas gotas tienen sus moléculas fuertemente cohesionadas y permanecen de ese modo sin derramarse.
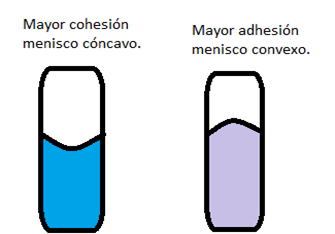
Tomemos un pequeño y estrecho tubo y llenémoslo de agua hasta cierto nivel. Luego hagamos lo mismo con un vaso y comparemos las muestras. Como pasó con el vaso del anterior experimento, la línea formada por la superficie del líquido es recta. Todo en orden, ¿no? Pero resulta que nuestro amigo el tubo capilar (así se llama) no es de los que les gustan las líneas rectas. Al contrario, el agua forma un menisco (una curva) cóncavo (se hunde hacia abajo) ¿Por qué? Pues, la fuerza de adhesión entre la superficie del agua y las paredes del tubo es mayor que la propia fuerza de cohesión entre las moléculas del agua. El resultado es que el agua fluya hacia arriba, ascendiendo un poco y dejando ese menisco.
Mas, como nuestra amiga la gravedad deja que la venzan, pero hasta un punto determinado, el agua no puede seguir subiendo. Pero… las fuerzas de cohesión entre las moléculas del líquido no siempre son menores que la adhesión entre el líquido y las paredes del recipiente. Cuando esta (la cohesión) es mayor, el menisco va hacia el otro lado y resulta convexo (se genera una protuberancia, como en el vaso a punto de desbordarse). Esto pasa por la unión entre las moléculas del líquido, que supera a la atracción del recipiente. La cohesión, por su importancia en la tensión superficial y su presencia, gana la pelea. Lo siento por los fans de la adhesión (o adhefans).
En el caso del vaso, el flujo del agua se desvía porque la adhesión vence momentáneamente a la fuerza de gravedad y el agua fluye por las paredes externas. Cuando para de fluir, se forman gotas que van cayendo en un nuevo flujo de agua. Para evitar este problema se debe verter el agua de forma que su velocidad venza la adhesión.
En el gotero, el agua se va acumulando en una gota por la acción de la cohesión entre sus moléculas, hasta llegar a un límite y caer, dando paso a la creación de una nueva gota. A estos ejemplos podemos adicionarles la ley de Tate, que dice que dos gotas de un mismo gotero son exactamente iguales para un mismo líquido, y que las gotas se desprenden cuando su peso es numéricamente igual a su fuerza de tensión superficial.

 Por Yohancer Tabares Pérez, estudiante de décimo grado del IPU Carlos Pérez Domínguez
Por Yohancer Tabares Pérez, estudiante de décimo grado del IPU Carlos Pérez Domínguez